«Системы CRISPR-Cas» в бактериях и вирусах идентифицируют и уничтожают вторгающиеся вирусные последовательности. Это бактериальная и архейная иммунная система для защиты от вирусных инфекций. В 2012 году система CRISPR-Cas была признана геном инструмент редактирования. С тех пор был разработан широкий спектр систем CRISPR-Cas, которые нашли применение в таких областях, как генная терапия, диагностика, исследования и улучшение сельскохозяйственных культур. Однако доступные в настоящее время системы CRISPR-Cas имеют ограниченное клиническое применение из-за частых случаев нецелевого редактирования, неожиданных мутаций ДНК и наследственных проблем. Исследователи недавно сообщили о новой системе CRISPR-Cas, которая может нацеливать и уничтожать мРНК и белки более точно связаны с различными генетическими заболеваниями без нецелевого воздействия и наследственных проблем. Названная Craspase, это первая система CRISPR-Cas, которая демонстрирует белок функция редактирования. Это также первая система, которая может редактировать как РНК, так и белок. Поскольку Craspase преодолевает многие ограничения существующих систем CRISPR-Cas, у него есть потенциал совершить революцию в генной терапии, диагностике и мониторинге, биомедицинских исследованиях и улучшении сельскохозяйственных культур.
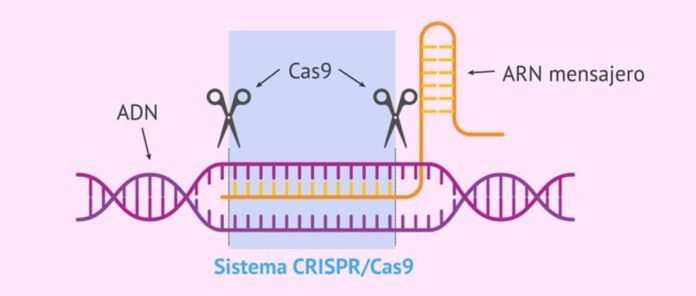
«Система CRISPR-Cas» — это естественная иммунная система бактерий и архей против вирусных инфекций, которая идентифицирует, связывает и разрушает последовательности вирусного гена для защиты. Он состоит из двух частей: бактериальной РНК, транскрибируемой с вирусного гена, включенного в бактериальный геном после первой инфекции (так называемая CRISPR, она идентифицирует целевые последовательности вторгшихся вирусных генов) и связанного с ней разрушителя. белок под названием «CRISPR-ассоциированный белок (Cas)», который связывает и разрушает идентифицированные последовательности вирусного гена, защищая бактерии от вирусов.
ЧИСТОЕ означает «кластеризованные короткие палиндромные повторы с регулярными интервалами». Это транскрибируемая бактериальная РНК, характеризующаяся палиндромными повторами.
Палиндромные повторы (CRISPR) впервые были обнаружены в последовательностях E. палочки в 1987 году. В 1995 году Франсиско Мохика наблюдал подобные структуры у архей, и именно он первым подумал о них как о части иммунной системы бактерий и архей. В 2008 году впервые экспериментально было показано, что мишенью иммунной системы бактерий и архей является чужеродная ДНК, а не мРНК. Механизм идентификации и деградации вирусных последовательностей позволил предположить, что такие системы можно использовать в качестве инструмента для редактирование генома. С момента своего признания в качестве инструмента редактирования генома в 2012 году система CRISPR–Cas прошла долгий путь как прочно утвердившийся стандарт. редактирование гена система и нашла широкий спектр применения в биомедицине, сельском хозяйстве, фармацевтической промышленности, в том числе в клинической генной терапии.1,2.
Широкий ассортимент CRISPR-Системы Cas уже идентифицированы и в настоящее время доступны для мониторинга и редактирования последовательностей ДНК/РНК для исследований, скрининга лекарств, диагностики и лечения. Существующие системы CRISPR/Cas разделены на 2 класса (класс 1 и 2) и шесть типов (типы от I до XI). Системы класса 1 имеют несколько Cas белки которым необходимо сформировать функциональный комплекс для связывания и воздействия на свои цели. С другой стороны, системы класса 2 имеют только один большой Cas белок для связывания и разрушения целевых последовательностей, что упрощает использование систем класса 2. Обычно используемые системы класса 2 — это Cas 9 Type II, Cas13 Type VI и Cas12 Type V. Эти системы могут иметь нежелательные побочные эффекты, то есть нецелевое воздействие и цитотоксичность.3,5.
Генная терапия Системы, основанные на существующих системах CRISPR-Cas, имеют ограниченное клиническое применение из-за частых случаев нецелевого редактирования, неожиданных мутаций ДНК, включая делеции больших фрагментов ДНК и крупные структурные варианты ДНК как в целевых, так и в нецелевых сайтах, что приводит к гибели клеток. и другие наследственные проблемы.
Краспаза (или каспаза, управляемая CRISPR)
Исследователи недавно сообщили о новой системе CRISPER-Cas, которая представляет собой систему Cas2-7 класса 11 типа III-E, связанную с каспазоподобной системой. белок отсюда и название Краспаза или каспаза, управляемая CRISPR 5 (Каспазы — это цистеиновые протеазы, которые играют ключевую роль в апоптозе и разрушении клеточных структур). Он имеет потенциальное применение в таких областях, как генная терапия и диагностика. Краспаза направляется РНК и нацелена на РНК и не взаимодействует с последовательностями ДНК. Он может нацеливать и уничтожать мРНК и белки более точно связаны с различными генетическими заболеваниями без нецелевого воздействия. Таким образом, устранение генов, связанных с заболеваниями, возможно путем расщепления на уровне мРНК или белка. Кроме того, когда краспаза связана со специфическим ферментом, ее можно использовать для модификации функций белков. Когда функции РНКазы и протеазы удаляются, краспаза деактивируется (dCraspase). Он не выполняет разрезающей функции, но связывается с последовательностями РНК и белков. Таким образом, dCraspase можно использовать в диагностике и визуализации для мониторинга и диагностики заболеваний или вирусов.
Краспаза — первая система CRISPR-Cas, обладающая функцией редактирования белков. Это также первая система, которая может редактировать как РНК, так и белок. Его редактирование гена Функция обеспечивает минимальные нецелевые эффекты и не имеет наследственных проблем. Следовательно, краспаза, вероятно, будет более безопасной при клиническом использовании и терапии, чем другие доступные в настоящее время системы CRISPR-Cas. 4,5.
Поскольку Craspase преодолевает многие ограничения существующих систем CRISPR-Cas, он может произвести революцию в генной терапии, диагностике и мониторинге, биомедицинских исследованиях и улучшении урожая. Необходимы дополнительные исследования для разработки надежной системы доставки для точного нацеливания на гены, вызывающие заболевания, в клетках, прежде чем доказывать безопасность и эффективность в клинических испытаниях.
Ссылки:
- Гостимская, И. CRISPR-Cas9: история его открытия и этические аспекты его использования в редактировании генома. Биохимия Москва 87, 777–788 (2022). https://doi.org/10.1134/S0006297922080090
- Чао Ли и др. 2022. Вычислительные инструменты и ресурсы для редактирования генома CRISPR/Cas. Геномика, протеомика и биоинформатика. Доступно в сети с 24 марта 2022 г. DOI: https://doi.org/10.1016/j.gpb.2022.02.006
- van Beljouw, SPB, Sanders, J., Rodríguez-Molina, A. et al. Системы CRISPR-Cas, нацеленные на РНК. Nat Rev Microbiol 21, 21–34 (2023). https://doi.org/10.1038/s41579-022-00793-y
- Чуньи Ху и др. 2022. Краспаза представляет собой РНК-активируемую протеазу, управляемую CRISPR. Наука. 25 августа 2022 г. Том 377, выпуск 6612. стр. 1278-1285. DOI: https://doi.org/10.1126/science.add5064
- Хуо, Г., Шеперд, Дж. и Пан, X. Краспаз: новый редактор двойных генов CRISPR/Cas. Функциональная и интегративная геномика 23, 98 (2023). Опубликовано: 23 марта 2023 г. DOI: https://doi.org/10.1007/s10142-023-01024-0